| 有効成分 [1錠中] |
添加剤 |
| タダラフィル 10mg | カルナウバロウ、クロスカルメロースNa、結晶セルロース、酸化チタン、三二酸化鉄、ステアリン酸Mg、タルク、乳糖、ヒドロキシプロピルセルロース、ヒプロメロース、マクロゴール6000、ラウリル硫酸Na |
| 有効成分 [1錠中] |
添加剤 |
| タダラフィル 20mg | カルナウバロウ、クロスカルメロースNa、結晶セルロース、酸化チタン、三二酸化鉄、ステアリン酸Mg、タルク、乳糖、ヒドロキシプロピルセルロース、ヒプロメロース、マクロゴール6000、ラウリル硫酸Na |
一般的名称 |
タダラフィル錠 |
警告
|
禁忌(次の患者には投与しないこと)
|
適用上の注意
生物学的同等性試験
○タダラフィル錠10mgCI「サワイ」
タダラフィル錠10mgCI「サワイ」と標準製剤を健康成人男子にそれぞれ1錠(タダラフィルとして10mg)空腹時単回経口投与(クロスオーバー法)し、血漿中タダラフィル濃度を測定した。得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された。1)
○タダラフィル錠20mgCI「サワイ」
タダラフィル錠20mgCI「サワイ」と標準製剤を健康成人男子にそれぞれ1錠(タダラフィルとして20mg)空腹時単回経口投与(クロスオーバー法)し、血漿中タダラフィル濃度を測定した。得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された。2)
血漿中濃度ならびにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
| 10mg錠各1錠投与時の薬物動態パラメータ | ||||
|
|
Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | AUC0-72hr(ng・hr/mL) |
| タダラフィル錠10mgCI「サワイ」 | 192.7±51.4 | 1.9±1.5 | 16.4±4.8 | 3437±1153 |
| 標準製剤(錠剤、10mg) | 187.0±55.3 | 2.5±1.9 | 15.5±3.4 | 3286±724 |
(Mean±S.D., n=16)
| 20mg錠各1錠投与時の薬物動態パラメータ | ||||
 |
Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | AUC0-72hr(ng・hr/mL) |
| タダラフィル錠20mgCI「サワイ」 | 333.1±106.7 | 2.6±1.3 | 17.0±4.0 | 7329±1963 |
| 標準製剤(錠剤、20mg) | 359.3±86.1 | 2.8±0.9 | 17.3±4.6 | 7464±1768 |
(Mean±S.D., n=16)
副作用等発現状況の概要
本剤は使用成績調査等の副作用発現頻度が明確となる調査を実施していない。
重大な副作用
(頻度不明)
過敏症(発疹、蕁麻疹、顔面浮腫、剥脱性皮膚炎、Stevens-Johnson症候群):本剤の投与により発疹、蕁麻疹、顔面浮腫、剥脱性皮膚炎、Stevens-Johnson症候群等の過敏症が、ごくまれに報告されている。このような症状が認められた場合には、本剤の投与を中止し、適切な処置を行うこと。
| 頻度不明 | |
| 循環器 | 潮紅、動悸、ほてり、血管拡張、心拍数増加、胸痛、狭心症、頻脈、高血圧、低血圧、心筋梗塞注1)、心臓突然死注1)、失神、起立性低血圧 |
| 感覚器 | 霧視、眼の充血、眼の異常感、耳鳴、視覚障害、眼痛、流涙増加、眼刺激、結膜充血、視野欠損、結膜炎、乾性角結膜炎、眼瞼腫脹、色覚変化、回転性眩暈、網膜静脈閉塞、非動脈炎性前部虚血性視神経症注2)、網膜動脈閉塞 |
| 消化器 | 消化不良、上腹部痛、悪心、胃食道逆流性疾患、下痢、口内乾燥、胃炎、嘔吐、腹痛、胃(胸部)不快感、便秘、腹部膨満、軟便、胃刺激症状、嚥下障害、食道炎 |
| 肝臓 | 肝機能異常(AST(GOT)上昇、ALT(GPT)上昇、γ-GTP上昇を含む)、Al-P上昇 |
| 腎臓 | 腎機能障害、尿酸値上昇 |
| 筋骨格 | 背部痛、筋痛、四肢痛、関節痛、筋痙攣(筋収縮)、筋骨格痛、筋骨格硬直、頚部痛、殿部痛 |
| 精神神経系 | 頭痛、めまい、睡眠障害、錯感覚、傾眠、不安、脳卒中注1)、感覚鈍麻、片頭痛 |
| 泌尿・生殖器 | 排尿困難、勃起増強、意図しない勃起、持続勃起症、勃起の延長 |
| 呼吸器 | 鼻閉、鼻炎、副鼻腔うっ血、呼吸困難、喀血、鼻出血、咽頭炎 |
| 皮膚 | 紅斑、多汗、爪囲炎、そう痒症 |
| その他 | 疲労、無力症、疼痛、体重増加、倦怠感、熱感、末梢性浮腫、粘膜浮腫、口渇 |
上記のような副作用が認められた場合には、必要に応じ、減量、投与中止等の適切な処置を行うこと。
注1)心筋梗塞、心臓突然死、脳卒中等の重篤な有害事象が本剤の投与後に報告されている。しかし、これらのほとんどの症例が本剤投与前から心血管系障害等の危険因子を有していたことが報告されており、これらの事象が本剤、性行為又は患者が以前から有していた心血管系障害の危険因子に起因して発現したものなのか、又は、これらの要因の組合せにより発現したものなのかを特定することはできない。
| 外形 | 剤形 | 性状 | 直径(mm) | 厚さ(mm) | 重量(mg) | 識別コード |
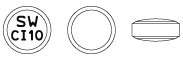 |
フィルムコーティング錠 | うすい黄色 | 8.1 | 3.8 | 約208 | SW CI 10 |
| 外形 | 剤形 | 性状 | 直径(mm) | 厚さ(mm) | 重量(mg) | 識別コード |
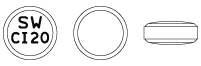 |
フィルムコーティング錠 | うすい黄色 | 9.1 | 4.0 | 約281 | SW CI 20 |
(併用に注意すること)
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| CYP3A4阻害剤 ケトコナゾール イトラコナゾール クラリスロマイシン テラプレビル グレープフルーツジュース 等 |
強いCYP3A4阻害作用を有するケトコナゾール(経口剤、国内未発売)との併用により、本剤のAUC及びCmaxが312%及び22%増加するとの報告がある。 | CYP3A4阻害によるクリアランスの減少。 |
| HIVプロテアーゼ阻害剤 リトナビル インジナビル サキナビル ダルナビル 等 |
リトナビルとの併用により、本剤のAUCが124%増加するとの報告がある。 | CYP3A4阻害によるクリアランスの減少。 |
| CYP3A4誘導剤 リファンピシン フェニトイン フェノバルビタール 等 |
リファンピシンとの併用により、本剤のAUC及びCmaxがそれぞれ88%及び46%低下するとの報告がある。 | CYP3A4誘導によるクリアランスの増加。 |
| α遮断剤 ドキサゾシン テラゾシン 等 |
ドキサゾシンとの併用により、立位収縮期血圧及び拡張期血圧は最大それぞれ9.81mmHg及び5.33mmHg下降するとの報告がある。 また、α遮断剤との併用で失神等の症状を伴う血圧低下を来したとの報告がある。 |
本剤は血管拡張作用による降圧作用を有するため、併用により降圧作用を増強するおそれがある。 |
| 降圧剤 アムロジピン メトプロロール エナラプリル カンデサルタン 等 |
アンジオテンシンII受容体拮抗剤(単剤又は多剤)との併用により、自由行動下収縮期血圧及び拡張期血圧は最大それぞれ8mmHg及び4mmHg下降するとの報告がある。 | 本剤は血管拡張作用による降圧作用を有するため、併用により降圧作用を増強するおそれがある。 |
| カルペリチド | 併用により降圧作用が増強するおそれがある。 | 本剤は血管拡張作用による降圧作用を有するため、併用により降圧作用を増強するおそれがある。 |
(次の患者には慎重に投与すること)
一般名
タダラフィル(Tadalafil)
化学名
(6R,12aR)-6-(1,3-Benzodioxol-5-yl)-2-methyl-2,3,6,7,12,12a-hexahydropyrazino[1′,2’:1,6]pyrido[3,4-b]indole-1,4-dione
分子式
C22H19N3O4
分子量
389.40
構造式
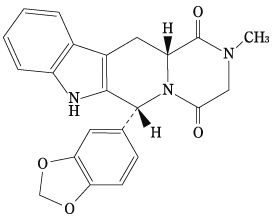
性状
白色の粉末である。ジメチルスルホキシドに溶けやすく、水にほとんど溶けない。
取扱い上の注意
・安定性試験
PTP包装したものを用いた加速試験(40℃75%RH、6ヶ月)の結果、通常の市場流通下において3年間安定であることが推測された。4)、5)
タダラフィル錠10mgCI「サワイ」:
PTP:20錠(10錠×2)、40錠(10錠×4)タダラフィル錠20mgCI「サワイ」:
PTP:20錠(10錠×2)、40錠(10錠×4)
沢井製薬株式会社 医薬品情報センター
当添付文書はPDF版の添付文書を見やすいようにHTMLに置き換えて告知しています。
すべての著作権は製造元、販売元に帰属します。
HTML版編集元: 新宿ウエストクリニック・渋谷ウエストクリニック